Observações para colheita de amostras
Colheita de Sangue
Sangue em Tubo Seco - Soro
- Colher por punção venosa no mínimo 3,0 ml de sangue. Este procedimento deve demorar no máximo 2 minutos.
- Quando utilizada seringa, abrir a tampa do tubo, retirar a agulha da seringa e transferir o sangue para o tubo deixando-o escorrer pela parede do frasco.
- Manter refrigerado (2- 8ºC).

Sangue em EDTA - Plasma
- Colher por punção venosa de 1 a 3 ml de sangue (o volume colhido pode variar conforme o tamanho do frasco disponível).
– Este procedimento deve demorar no máximo 1 a 1,5 minutos. - Quando utilizada seringa, abrir a tampa do tubo, retirar a agulha da seringa e transferir o sangue para o tubo deixando-o escorrer pela parede do frasco.
- Tampar e homogeneizar por inversão, por no mínimo 30 segundos.
- Manter a amostra de sangue em EDTA refrigerada (2- 8ºC).
Sangue em Fluoreto - Plasma
- Colher por punção venosa no mínimo 3,0 ml de sangue.
– Este procedimento deve demorar no máximo 2 minutos. - Quando utilizada seringa, abrir a tampa do tubo, retirar a agulha da seringa e transferir o sangue para o tubo deixando-o escorrer pela parede do frasco.
- Manter a amostra de sangue em fluoreto refrigerada (2- 8ºC).
Colheita de Fezes

Coletor Universal Plástico
- Colher amostras de fezes frescas, recém-eliminadas, em frasco limpo e refrigerá-las imediatamente (2- 8ºC).
- Amostras muito líquidas podem ser colhidas do piso com o auxílio de seringa.
- A amostra também pode ser colhida diretamente do reto.
- No exame coprológico funcional, para avaliação da eficácia da digestão de fibras musculares, fornecer carne crua cerca de 12 horas antes da colheita, o que deverá ser informado na requisição.
- Quantidade: 10 a 20 g ou 10 a 20 ml.
Colheita de Urina
Tubo Cônico, Coletor Universal ou Seringa:
Colher amostra de urina preferencialmente com sonda ou por cistocentese, ou ainda por micção espontânea após antissepsia de vulva/prepúcio e desprezando os primeiros jatos. Colocar no coletor ou deixar na seringa. Refrigerar imediatamente (2- 8ºC).
Volume indicado: 10 ml. Excepcionalmente são aceitos volumes inferiores.
Colheita para Cultura Bacteriana
Swab, Coletor Universal Estéril, Seringa ou Tubo Estéril
Manter o material colhido sempre sob refrigeração (2-8°C).
- Lesões profundas fechadas: realizar rigorosa antissepsia da região externa e puncionar com seringa e agulha.
- Fístulas e abscessos abertos: realizar tricotomia e rigorosa antissepsia da região externa e espremer o material da profundidade, colhendo a secreção com swab ou seringa.
- Ouvidos: realizar rigorosa antissepsia da região externa do pavilhão auricular e colher diretamente do conduto com swab.
- Vagina/Útero: realizar rigorosa antissepsia da região vulvar e colher com swab.
- Outros: consultar.
Colheita para Hemocultura
Frasco com Meio para Hemocultura
Realizar tricotomia, antissepsia de pele com álcool iodado, deixar secar. Atenção para não palpar novamente a pele sobre a veia a ser puncionada. Proceder a desinfecção da tampa do frasco antes da inoculação de pelo menos 2 ml de sangue.
Frasco com meio para hemocultura: solicitar a entrega do frasco com antecedência.
Colheita para Cultura Fúngica
- Micoses Superficiais e Exame Direto: Realizar raspado de escamas superficiais de pele e pelos, acondicionar em recipiente limpo ou entre lâminas de microscopia (manter em temperatura ambiente).
- Micoses Profundas: Realizar tricotomia e rigorosa antissepsia da região externa e espremer o material da profundidade, colhendo o exsudato com swab ou seringa (manter refrigerado).
Colheita para pesquisa de Ectoparasitas
Fazer raspado profundo das lesões até produzir discreto sangramento.
Colocar o produto deste raspado entre lâminas e manter à temperatura ambiente.
Não colocar óleo em hipótese alguma.
Condicionamento de Cálculos Urinários
Coletor Universal ou Tubo Cônico: Lavá-los com solução fisiológica e colocá-los em frasco limpo e seco. Mantê-los em temperatura ambiente.
Colheita de Efusões: Pleural, Peritoneal e Sinovial
Colher o fluído com seringa e passar cerca de 1 a 3 ml em frasco de tampa roxa (o volume colhido pode variar conforme o tamanho do frasco disponível) e 3 ml para o frasco de tampa vermelha.
Manter refrigerado (2- 8ºC).
Colheita de Líquor (LCR)
Colher LCR com seringa e passar cerca de 1 a 2 ml em frasco de tampa roxa, e cerca de 1 a 2 ml para o frasco de tampa vermelha. Manter refrigerado (2- 8ºC).
Colheita para Citologia Vaginal
Colher com swab ou escova cervical esfregando na parede vaginal. Afastar os lábios vulvares com uma das mãos e inserir o swab ou escova em ângulo aproximado de 45º, visando a esfoliação da mucosa vaginal, evitando a fossa clitoriana. Rolar o material sobre a(s) lâmina(s), secar ao ar e manter em porta-lâminas bem fechado à temperatura ambiente.
Colheita para Citologia
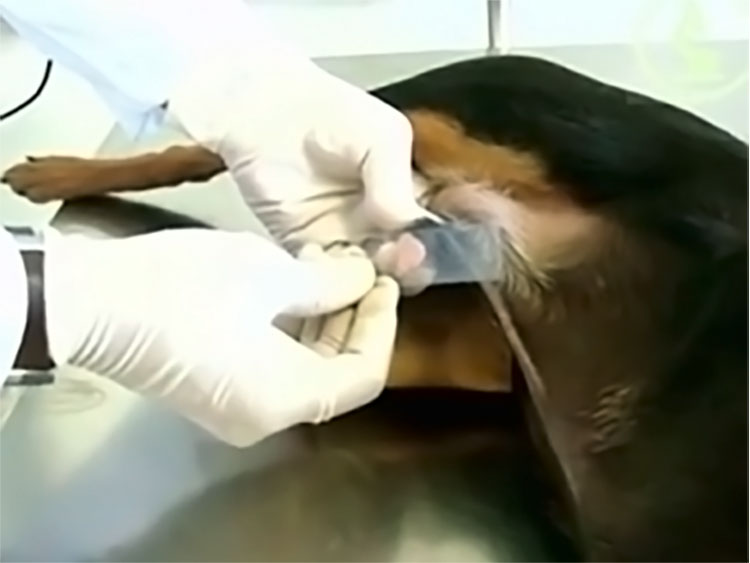
CITOLOGIA ASPIRATIVA POR AGULHA FINA (CAAF)
A Citologia Aspirativa por Agulha Fina (CAAF) é um método diagnóstico introduzido na medicina humana na década de 1930, para diagnóstico de neoplasias. Esta técnica passou a ser adotada na Medicina Veterinária a partir da década de 1980. É utilizada para diagnóstico diferencial de hiperplasias, inflamações, neoplasias e degenerações.
O exame citopatológico tem como principais vantagens o custo acessível e a rapidez e a simplicidade com que se estabelece o diagnóstico. Também é um método seguro, que não gera riscos à vida do paciente, além de não requerer equipamento sofisticado, sedação ou anestesia para sua realização.
As técnicas aspirativas são indicadas para o diagnóstico de lesões nodulares palpáveis, possibilitando também a aspiração de fluídos corporais, efusões cavitárias, órgãos como o baço, fígado, rins, pulmões, ossos, além de estruturas glandulares
como a tireoide e próstata ou massas intracavitárias de origem desconhecida.
A citologia guiada por ultrassom orienta a colheita de modo que não haja perfuração de estruturas adjuntas às massas, o que garante maior segurança na aplicação da técnica quando se tratam de formações intracavitárias ou que não são palpáveis superficialmente.
A confiabilidade da informação obtida pela citopatologia depende do adequado processamento e coloração das lâminas associada à perícia do Patologista Veterinário.
As principais complicações da citopatologia poderiam se relacionar à hemorragia, infecção, injúria ao tecido adjacente e disseminação de células neoplásicas, porém, esses efeitos são muito raros. No caso de neoplasias malignas, por ser mínima a lesão provocada pela agulha fina, o risco de provocar metástases é insignificante quando comparada à biópsia cirúrgica.
Método:
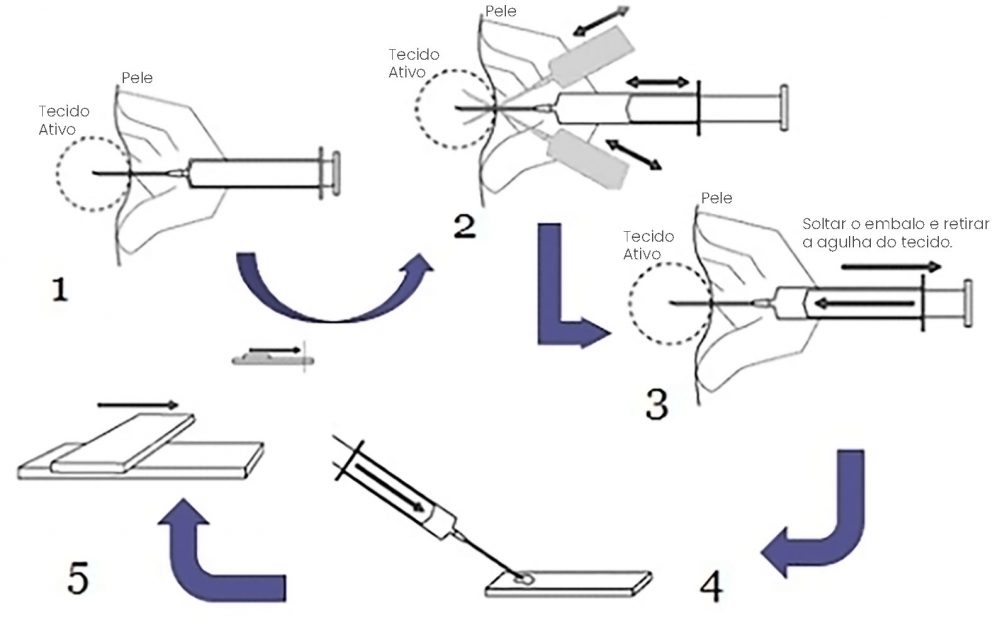
- Identificar a formação ou órgão por palpação, radiografia ou ultrassom.
- Realizar a antissepsia da área que será puncionada.
- Para a punção são indicadas agulhas estéreis de calibre 20, 23 ou 25 e seringas estéreis de 10 ou 20 ml para gerar a pressão de sucção necessária para o procedimento.
- Após acoplar a agulha na seringa, esta deve ser introduzida na estrutura a ser puncionada por 3 a 4 vezes em pontos diversos do nódulo ou formação, mantendo-se a pressão de sucção de no mínimo 5 ml e no máximo 10 ml. São realizados movimentos com a agulha em várias direções dentro da lesão para garantir a colheita de maior e mais diversa quantidade de representantes celulares.
- Antes de remover a agulha, deve-se retornar o êmbolo para a posição inicial (vácuo nulo).
- Retirar a agulha da massa e desencaixá-la da seringa.
- Encher a seringa de ar, acoplar novamente a agulha e ejetar o aspirado em lâmina nova ou desengordurada. Devem ser feitas, no mínimo, três lâminas do tecido suspeito.
- Se o conteúdo for fluído, deve-se preparar as lâminas como se faz para extensões sanguíneas.
- A aspiração de sangue deve ser evitada, já que as hemácias em grande quantidade, dificultam o diagnóstico citológico.
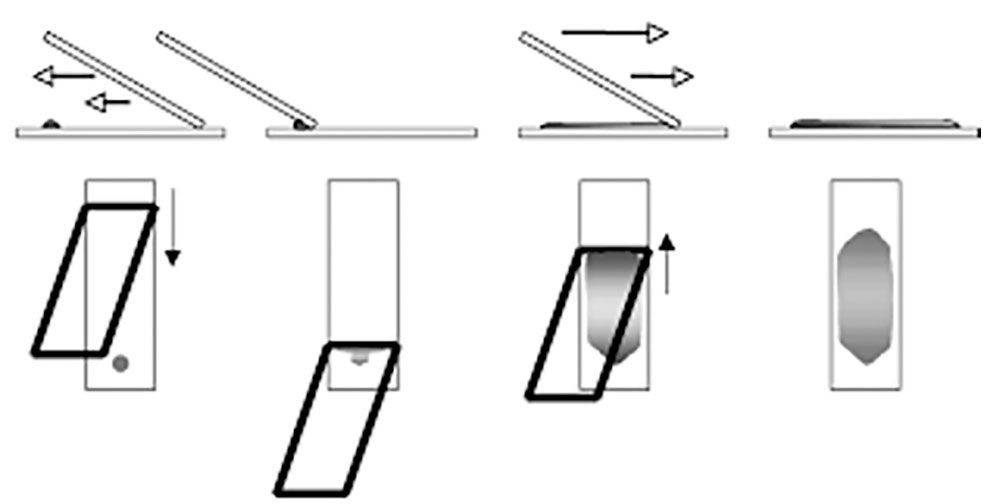
"SQUASH"
Denomina-se “Squash” o método de eleição para preparação de lâminas de CAAF.
É utilizado principalmente quando conteúdo é viscoso e denso.
Método:
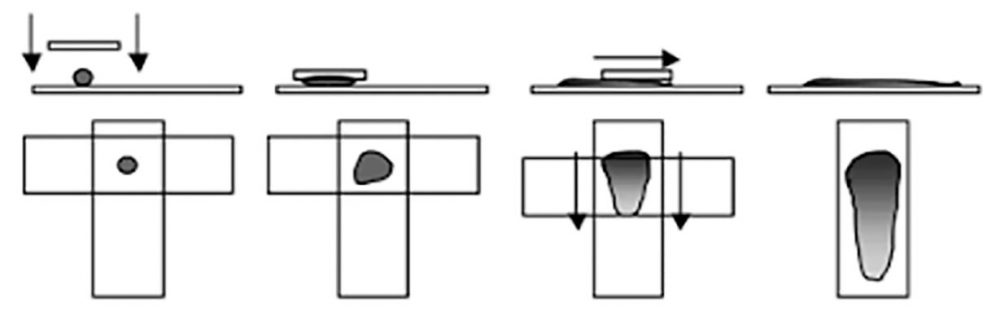
- O material é colocado na extremidade da lâmina próximo à borda fosca.
- Outra lâmina é posicionada perpendicularmente sobre a lâmina que contém o material.
- Esta segunda lâmina é apoiada sobre o material, comprimindo-o levemente para criar aderência, e deslizada suavemente ao longo do comprimento da primeira lâmina espalhando o conteúdo, conforme demonstra a figura acima.
- Secar ao ambiente.
Decalque, Impressão ("IMPRINT") ou "CLAPS"
Denomina-se citologia por decalque, impressão ou “claps” o procedimento no qual se coloca a a área do tecido em contato com a superfície da lâmina de vidro, de modo semelhante ao utilizado para se obter uma impressão digital. Neste método, as células superficiais da lesão são transferidas para a superfície da lâmina.
É utilizado normalmente a partir de fragmentos obtidos durante necropsias, biópsias ou diretamente em lesões cutâneas.

Referência: AYELE et al, 2017.
- Para fragmentos de tecido: obter fragmentos com 1 a 2 cm2; secar levemente em papel de filtro (A); pressionar levemente sobre a lâmina em vários locais ao longo de seu comprimento (B, C).
- Para lesões cutâneas: a lâmina é pressionada diretamente contra a área da lesão (figura à direita).
- Secar o material ao ambiente.
Extensões de líquidos,
derrames cavitários e lavados
Método:
- Após a colheita do líquido, derrame cavitário ou lavado, colocar uma pequena gota da amostra sobre a extremidade de uma lâmina de microscopia nova ou previamente desengordurada.
- Encostar a extremidade de outra lâmina e deslizá-la com movimento suave contínuo.
- Secar ao ambiente.
Histopatológicos - Biópsias
e material de necropsia
Enviar material fixado em formol a 10 %, sendo o volume de fixador aproximadamente 10 vezes maior que o volume da peça, em frasco de boca larga, bem vedado.
Amostra de Animais Silvestres/ Selvagens
A maioria das provas bioquímicas e hematológicas pode ser realizada em amostras colhidas em EDTA. Assim, no caso de animais onde o volume a ser colhido é reduzido, recomendamos o uso do tubo de tampa roxa para o acondicionamento de toda amostra obtida. Tal procedimento promove maior rendimento de plasma para determinações bioquímicas e menor risco de hemodiluição. Além disso, o EDTA, quando comparado com a heparina, oferece menor probabilidade de formação de microcoágulos.
O sangue de algumas aves (avestruzes, emas, mutuns) e de alguns répteis (iguanas, jabutis) sofre hemólise intensa em contato com EDTA, nestes casos usar heparina (tubo de tampa verde) ou citrato (tubo de tampa azul).
A heparina interfere no processo de coloração das células e gera artefatos, sendo imprescindível a confecção de esfregaço sanguíneo a fresco quando solicitado hemograma. Quando solicitadas apenas provas bioquímicas recomendamos o uso da heparina.
Lembramos que amostras compartilhadas com mais de uma seção do laboratório poderão ter prazo de entrega de resultados ampliado devido à necessidade de procedimentos de aliquotagem.
